近日,湘雅科研团队取得了多项突破。敲黑板!一起看看2025年12月的科研成果吧~
以下成果根据湘雅各二级OD(中国)官方、附属医院官网等整理。
刘昭前团队发表肺癌免疫治疗相关不良反应的遗传预测新靶点原创性研究
龚学军团队系列研究揭示纳米药物新策略,高效治疗急性胰腺炎
湘雅二医院整形美容与烧伤外科团队发表DNA仿生多功能自修复水凝胶促进糖尿病创面修复研究成果
刘军团队创新提出肿瘤免疫治疗新方法
黎志宏团队在国际知名期刊发表系列重要研究成果
李霞团队揭示口腔-肠道菌群与T1D血管并发症的关联特征
陈章玲团队发表论文揭示生活方式对心血管代谢健康的多维影响
田静团队在《Materials Today Bio》提出工程化细胞药物递送系统新设计框架
武明花课题组构建肿瘤纳米治疗新策略
余正课题组在《Nature Communications》发表 肠道甲烷氧化菌的原创性研究成果
周艳宏课题组揭示抑制素βA通过调控巨噬细胞M2极化和线粒体依赖性铁死亡促进结直肠癌恶性进展的新机制
张剑英团队在国际衰老顶刊《Nature Aging》发表专家意见
刘昭前团队发表肺癌免疫治疗相关不良反应的遗传预测新靶点原创性研究
近日,中南大学湘雅医院临床药理研究所刘昭前教授团队OD网页版肺癌免疫治疗相关不良反应的药物基因组学研究取得重要研究成果,相关成果发表在国际著名肿瘤学期刊《Cancer Letters》(《癌症通讯》,IF=10.1)上。
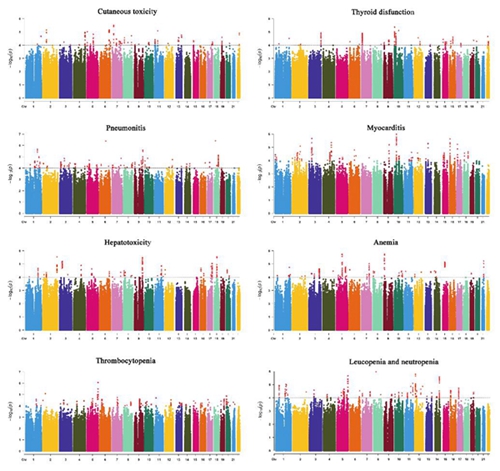
该研究采用两阶段全基因组关联研究(GWAS)设计,在包含785名接受PD-1/PD-L1抑制剂治疗的中国肺癌患者队列中,对8种irAEs(包括皮肤毒性、甲状腺功能异常、肺炎、心肌炎、肝毒性、贫血、血小板减少症和白细胞/中性粒细胞减少症)进行了独立的GWAS分析。研究成功识别并验证了3个与特定irAEs显著相关的新型SNP位点:rs192921786位点与免疫相关肺炎风险显著相关,rs2498632位点与贫血风险相关,而rs17080141位点则与血小板减少症风险相关。研究进一步明确,携带rs192921786的T等位基因、rs2498632的C等位基因和rs17080141的A等位基因的患者,发生相应不良反应的风险更高。基于eQTL分析和生物信息学探索,该研究还提出了这些基因位点可能通过调控STING信号通路、JAK-STAT炎症通路以及MAPK信号通路,分别影响肺癌免疫稳态、铁代谢平衡和血小板生成与破坏,从而导致特定irAEs发生的潜在作用模式。该研究为理解免疫治疗毒性的遗传机制提供了新的重要证据,发现的3个遗传位点是有潜力的irAEs预测生物标志物,对于推动肺癌患者的个体化免疫治疗、提前识别高风险人群并进行预防性干预具有重要的临床转化价值。
原文链接:https://doi.org/10.1016/j.canlet.2025.218168
龚学军团队系列研究揭示纳米药物新策略,高效治疗急性胰腺炎
近日,中南大学湘雅医院在急性胰腺炎(AP)的纳米药物治疗领域取得创新突破。两项重要成果分别发表在国际权威学术期刊《Advanced Science》(《先进科学》中科院一区,IF:14.3)和科院一区期刊《Journal of Controlled Release》(IF:11.5)上,这系列研究成果这些研究不仅深入探讨了AP的病理机制,还成功设计并验证了多种新型纳米药物,为AP的临床治疗提供了全新视角和策略,显著提升了AP的治疗效果。

其中一项重要成果发表在国际权威学术期刊《Advanced Science》(《先进科学》中科院一区,IF:14.3)上。研究团队首次设计并验证了一种新型线粒体靶向纳米抗氧化剂-单宁酸修饰的钨基杂多酸纳米药物。这种纳米药物能够精准识别受损BPB中暴露的III型胶原蛋白,高效穿越屏障后,进一步靶向结合胰腺腺泡细胞内的线粒体,直接清除过量ROS,阻断“线粒体损伤-炎症风暴”恶性循环。

另一项发表在中科院一区期刊《Journal of Controlled Release》(IF:11.5)上的研究进一步拓展了纳米药物在AP治疗中的应用。该研究设计了一种双重靶向的复合纳米药物(MTP)。MTP具有强大的ROS清除功能,能够主动识别损伤的BPB并靶向胰腺腺泡细胞的线粒体,而无需依赖复杂的靶向策略。这是迄今为止第一个使用超小带负电纳米点双重靶向AP的疗法。治疗机制研究表明,MTP通过减少线粒体ROS生成来抑制胰腺腺泡细胞凋亡,保护胰腺腺泡细胞线粒体,减少线粒体DNA释放,阻断cGAS/STING通路,并最终抑制巨噬细胞活化,消除炎症。这一发现为AP的线粒体靶向抗氧化纳米药物治疗提供了前所未有的机会。
湘雅二医院整形美容与烧伤外科团队发表DNA仿生多功能自修复水凝胶促进糖尿病创面修复研究成果
近日,中南大学湘雅二医院整形美容与烧伤外科团队在材料-医学交叉领域国际顶级期刊《Advanced Science》(中科院一区Top,IF=14.1)在线发表题为“DNA-Inspired Multi-Functional Double-Cross-Linking Self-Healing Hydrogel Promotes the Healing of Diabetic Wounds”的研究论文。该研究首创“碱基配对+动态共价”双交联策略,构建可注射、自修复、长效缓释的ATG@ExoCur水凝胶,实现糖尿病慢性创面“抗菌-抗氧化-促血管-免疫调节”四效协同,为临床转化提供全新范式。我院整形美容与烧伤外科方柏荣教授为共同通讯作者。
糖尿病足溃疡年发病率约8%,因高血糖微环境导致“持续感染-过度炎症-血管生成障碍”恶性循环,临床缺乏同时纠正多病理环节的一体化敷料。团队受DNA双螺旋碱基配对启发,首次将腺嘌呤(A)与胸腺嘧啶(T)单体接枝于天然多糖主链,通过A─T氢键与席夫碱双动态交联,形成可注射、可自愈的ATG水凝胶;并进一步负载脂肪干细胞外泌体-姜黄素复合物,突破游离姜黄素水溶性差、外泌体体内滞留时间短两大瓶颈。
该研究首次将“DNA碱基识别”原理引入天然多糖水凝胶设计,无需长链DNA即可实现分子级可逆交联,兼具低成本、高安全性、易放大生产优势,为慢性创面、压疮等难治性损伤提供新方案。

原文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202513784
刘军团队创新提出肿瘤免疫治疗新方法
近日,中南大学湘雅二医院放射科主任刘军教授课题组在国际权威学术期刊《化学工程杂志》(Chemical Engineering Journal)(影响因子13.2,TOP期刊,中科院一区)发表了题为《基于天然化合物大黄酸的双金属纳米片诱导铁死亡并激活STING通路通路以增强肿瘤免疫治疗》(Natural compound rhein-based bimetallic nanosheets to induce ferroptosis and activate STING pathway for enhanced cancer immunotherapy)的研究性论文。
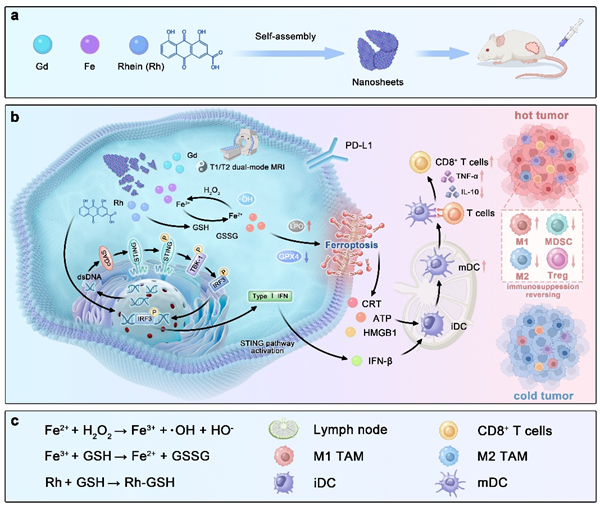
免疫抑制性肿瘤微环境(ITME)会促进肿瘤免疫逃逸,并导致对检查点阻断疗法产生耐药性。如何通过创新策略重新激活免疫监视,最终将"冷"肿瘤转化为"热"肿瘤,仍然是癌症免疫治疗领域面临的关键挑战。激活干扰素基因刺激因子信号(STING)通路为重塑ITME提供了一种前景广阔的策略,但现有的STING激动剂面临着快速降解和生物利用度差等局限性。基于此,团队通过Gd3+、Fe3+与天然化合物大黄酸的配位自组装,开发了一种多功能双金属-大黄酸纳米片(FGR NSs)。该FGR NSs能同时激活STING信号通路并诱导铁死亡。天然产物大黄酸会引发DNA双链断裂,从而促进STING激活,并将干扰素-b(IFN-b)的分泌量提高3.06倍。Fe3⁺通过芬顿反应催化内源性过氧化氢转化为剧毒的羟基自由基,并消耗谷胱甘肽(GSH),从而促进活性氧(ROS)的生成并驱动铁死亡。这些机制共同启动了先天性与适应性免疫应答,并释放出大量的损伤相关分子模式(DAMPs,包括CRT、ATP、HMGB1和IFN-β),进而促进树突状细胞成熟、CD8⁺T细胞启动以及巨噬细胞从M2型向M1型的复极化。此外,它还抑制了包括调节性T细胞(Tregs)和髓源性抑制细胞(MDSCs)在内的免疫抑制性细胞的浸润。
在体实验表明,FGR NSs在皮下乳腺癌模型中能引发强大的抗肿瘤效果,肿瘤生长抑制率(TGI)高达89.01%。当与免疫检查点抑制剂(aPD-1)联用时,在肺转移瘤模型中也实现了显著的肿瘤抑制效果。更重要的是,其Gd/Fe组分使该纳米片能够进行T1/T2双模式磁共振成像(MRI),这使FGR成为一个极具潜力的癌症免疫治疗诊疗一体化平台。
黎志宏团队在国际知名期刊发表系列重要研究成果
近日,中南大学湘雅二医院的黎志宏教授团队在国际知名期刊《Metabolism》(IF=11.9)上发表了题为” PRR14 mediates mechanotransduction and regulates myofiber identity via MEF2C in skeletal muscle” 的研究论文。本研究连接了两个至关重要的领域:机械生物学和表观遗传学。它阐明了物理力如何通过PRR14这样的分子传感器,转化为影响基因表达和细胞命运的长期生物学记忆。对于临床而言,这为无数遭受肌肉萎缩困扰的患者带来了全新的希望。无论是因年龄增长而出现的肌少症、因疾病或创伤导致的废用性肌萎缩,还是像杜氏肌营养不良这样的遗传性疾病,PRR14-MEF2C轴都成为一个极具潜力的治疗靶点。未来,科学家们可以探索通过小分子药物激活PRR14通路,或利用基因治疗手段补充PRR14,来对抗肌肉的流失。

文章链接:https://doi.org/ 10.1016/j.metabol.2024.156109
李霞团队揭示口腔-肠道菌群与T1D血管并发症的关联特征
近日,国家代谢性疾病临床医学研究中心、中南大学湘雅二医院李霞教授团队在《Cardiovascular Diabetology》期刊(中科院一区,影响因子10.6)发表了题为“Integrative oral and gut microbiome profiling highlights microbial correlates of complications in type 1 diabetes: a cross-sectional analysis”的原创性论文。唐蓉和石梅为共同第一作者,李霞教授为独立通讯作者。
1型糖尿病(T1D)是由遗传易感性和环境因素共同触发的自身免疫性疾病。胰岛素治疗虽已使其从急性致命疾病转变为可管理的慢性疾病,显著延长了患者生存期,但以微血管、大血管病变为主的慢性并发症仍是疾病负担和死亡的主要原因—即使积极控制血糖、血脂和血压,这些代谢干预仍不足以阻止并发症的发生和进展。该研究通过整合口腔和肠道菌群分析,揭示了菌群失调与长病程T1D患者慢性血管并发症的关联,鉴定出的26种肠道和8种口腔微生物可作为并发症相关的微生物特征,其中肠道产丁酸菌和口腔奈瑟菌的缺失和有害菌的增多可能加速T1D的血管损伤。微生物群可能通过“代谢-微生物-并发症”轴,参与介导代谢紊乱所致的血管并发症,且口腔和肠道菌群的相互作用也参与并发症发展。整合口腔和肠道菌群特征的预测模型可作为无创风险分层工具,为T1D血管并发症的预防和治疗提供了新的靶点。这些发现突出了靶向菌群策略在预防T1D相关并发症方面的潜力,也为开发基于微生物组的风险预测和干预策略奠定了基础。

原文链接:https://link.springer.com/article/10.1186/s12933-025-03012-z
陈章玲团队发表论文揭示生活方式对心血管代谢健康的多维影响
近期,中南大学湘雅二医院心血管内科陈章玲教授团队于国际权威期刊连续发表高水平原创论文,系统揭示了生活方式对心血管代谢健康的多维影响,为该类疾病的防治提供了从“生理营养”到“心理社会”层面的综合新证据。

在欧洲糖尿病学会官方旗舰期刊《糖尿病学》(Diabetologia)(IF=10.2),发表了题为“植物与动物来源的单不饱和脂肪酸摄入与2型糖尿病风险”(Monounsaturated fatty acids from plant or animal sources and risk of type 2 diabetes in three large prospective cohorts of men and women)的原创研究。研究发现,脂肪的来源和种类比总量更关键:植物来源的单不饱和脂肪酸(如橄榄油、菜籽油和坚果)可降低约13%的2型糖尿病风险,而动物来源的MUFA(如动物脂肪)则可增加约34%的风险。进一步分析显示,用植物MUFA替代反式脂肪(TSF)、动物MUFA及饱和脂肪酸(SFA),有助于降低糖尿病风险;相反,用动物MUFA错误替代SFA或精制碳水,则可能增加患病风险。该研究为日常膳食脂肪选择提供了清晰、可操作的科学指导。

在《国际外科学杂志》(International Journal of Surgery)(IF=10.4)上,发表了题为“Social isolation, loneliness, and genetic susceptibility in relation to the risk of incident osteoporosis: a prospective cohort study based on the UK biobank”的原创性论著。研究首次在大规模人群中证实,社交隔离与孤独感不仅影响心理健康,也可独立增加骨代谢疾病风险,风险分别上升约18%和25%,在遗传易感个体中效应更明显。研究提示,社交隔离与孤独可能通过激活慢性应激反应、升高皮质醇水平、诱发持续性低度炎症,干扰骨代谢平衡,并对心血管代谢健康造成潜在影响。
这两项研究共同构建了心血管代谢健康的新认知框架:“餐桌上的选择”和“生活中的社会连接”,均可通过炎症和内分泌通路影响代谢稳态,增加心血管代谢疾病风险。因此,心血管代谢疾病的防治策略需超越传统单一干预,迈向“营养–心理–社会”综合多维管理。
田静团队在《Materials Today Bio》提出工程化细胞药物递送系统新设计框架
近日,中南大学湘雅二医院风湿免疫科田静教授与浙江树人OD(中国)官方树兰医OD(中国)官方雷兰杰副教授合作,以共同通讯作者身份在生物医用材料领域权威期刊《Materials Today Bio》(中科院一区,影响因子10.2)上发表论文《Engineered cellular drug delivery: Strategies and applications》。该论文系统阐述了工程化细胞药物递送系统(ECDDS)的设计策略与前沿应用,并创新性地提出了指导其理性开发的“三轴心”设计范式。

细胞作为药物载体具有天然优势,但仍面临靶向性不足、药物释放不可控等瓶颈。ECDDS通过化学修饰、基因工程及膜杂交等技术,对红细胞、免疫细胞等载体进行改造,从而显著提升其递送性能。该研究首次构建了一个整合载体生物学特性、药物性质与组织微环境因素的“三轴心”框架,为精准设计ECDDS提供了系统性指导,同时详细阐述了细胞内工程、膜表面修饰及跨物种膜融合等核心工程策略,并总结了基于微环境响应(如pH、缺氧、超声等)的智能释药机制。ECDDS在肿瘤、感染及自身免疫性疾病治疗中展现出巨大潜力。工程化免疫细胞不仅能实现药物的靶向递送,还可协同重塑免疫微环境。
该研究不仅为克服传统药物递送系统的局限性提供了新思路,也为推动下一代智能化生物递送技术的临床转化奠定了重要理论基础。田静教授团队长期致力于风湿免疫病机制与治疗研究,雷兰杰教授团队则专注于生物材料与递送系统开发,此次跨学科合作为开发针对重大疾病的变革性治疗策略开辟了新路径。
原文链接:https://doi.org/10.1016/j.mtbio.2025.102579
武明花课题组构建肿瘤纳米治疗新策略
近日,中南大学湘雅基础医OD(中国)官方武明花课题组博士研究生邓坤和湘雅医院杨晓鑫助理研究员合作在国际生物医用材料领域高水平期刊《Advanced Healthcare Materials》在线发表了题为“A Functional Nanocomposite Tri-Activates Cuproptosis, Ferroptosis, and Mitophagy Death Pathway to Oppose Malignancies”的原创性研究论文。
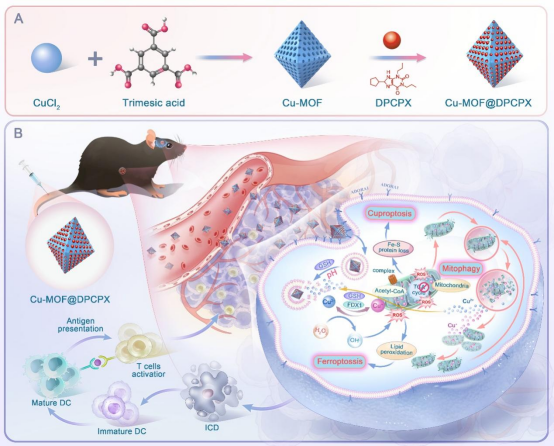
研究团队创新性地采用铜基金属有机框架(MOF-199)与化疗药物DPCPX联合,通过一锅共生法成功制备出新型纳米药物材料Cu-MOF@DPCPX。该纳米系统不仅具有精准靶向肿瘤受体ADORA1的能力,还具备卓越的pH响应性。Cu-MOF@DPCPX可在酸性肿瘤微环境中实现智能降解与铜离子的可控释放,从而多维度破坏癌细胞的生命链条:其一,驱动线粒体脂酰化酶聚集诱导典型的铜死亡(cuproptosis);其二,促进Fenton-like反应生成大量羟基自由基激活铁死亡(ferroptosis);其三,触发持续性线粒体损伤并诱导线粒体自噬(mitophagy);最终,通过三重细胞死亡通路的协同放大,Cu-MOF@DPCPX可导致肿瘤细胞全面崩解,并释放大量损伤相关分子模式(DAMPs),诱导免疫原性细胞死亡(ICD),实现肿瘤的深度杀伤。本研究不仅提出了以铜离子为核心驱动的“三通路联动”细胞程序性死亡的新策略,也首次证实了在铜死亡、铁死亡与线粒体自噬之间存在可循环放大的串联互作机制。
原文链接:https://doi.org/10.1002/adhm.202503530
余正课题组在《Nature Communications》发表 肠道甲烷氧化菌的原创性研究成果
近日,中南大学湘雅基础医OD(中国)官方人体微生物与健康课题组余正副教授团队在国际著名期刊《Nature Communications》(中科院一区Top期刊,IF=15.7)上在线发表了题为“The gut methanotroph Methylocystis intestini modulates intestinal peristalsis and fat metabolism via reducing methane levels”(肠道甲烷氧化菌M. intestini通过降低甲烷含量调节肠道蠕动和脂肪代谢)的原创性研究成果。这项研究为肠道微生物在人体健康中的重要作用提供了全新视角。

甲烷是人类肠道气体的重要组成部分,已有研究表明肠道中甲烷水平升高与肠道蠕动减慢密切相关。然而,OD网页版肠道内是否存在能够消耗甲烷的微生物—甲烷氧化菌及其对肠道蠕动的调节作用,至今尚无相关的研究。本研究首次从人体肠道样本中分离获得了一株新型肠道甲烷氧化菌——Methylocystis intestini,并系统性地证明了该菌在维持肠道功能中的重要作用,这一全新发现具有重大原创性和科学价值。
研究团队通过小鼠模型验证了甲烷过载会导致胃肠道动力功能紊乱,并且发现补充该甲烷氧化菌后,能够显著降低肠道内的甲烷水平,恢复正常的肠道蠕动功能。此外,团队对全球五大洲的1,207个宏基因组数据进行了大规模的调查分析,结果显示,超过91%的样本中均能检测到甲烷氧化基因的序列片段。这一发现表明,肠道甲烷氧化菌并非仅存在于特定人群中,而是广泛分布于全球范围内的人类肠道微生物组中,且在维持肠道健康方面发挥着至关重要的作用。
本研究首次阐明了肠道甲烷氧化菌在调节肠道甲烷水平及维持胃肠道功能稳态中的重要作用,为人体肠道微生态的气体代谢机制提供了突破性的科学证据。研究还提出,未来基于肠道微生态调控的干预策略,有望为治疗甲烷相关的胃肠动力功能障碍开辟新的方向,具有广阔的应用前景。
原文链接:https://www.nature.com/articles/s41467-025-66596-w
周艳宏课题组揭示抑制素βA通过调控巨噬细胞M2极化和线粒体依赖性铁死亡促进结直肠癌恶性进展的新机制
近日,中南大学湘雅基础医OD(中国)官方周艳宏课题组在《信号转导与靶向治疗》(Signal Transduction and Targeted Therapy,STTT,2024年IF值=52.7)发表最新研究成果,证明抑制素 βA通过促进巨噬细胞M2极化和抑制线粒体依赖性铁死亡驱动结直肠癌恶性进展(Inhibin beta A drives colorectal cancer progression through macrophage M2 polarization and mitochondria-dependent ferroptosis suppression)。
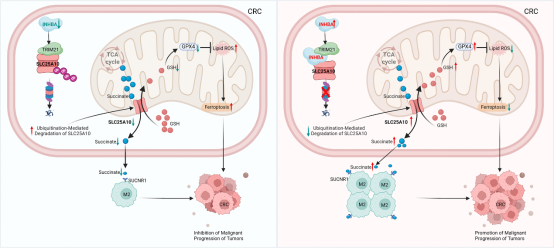
结直肠癌是全球高发恶性肿瘤,发病机制尚未完全阐明,且患者长期预后仍不理想,尤其是晚期或转移性病例。深入探究其分子机制、发现新治疗靶点和预后标志物,对改善患者临床结局至关重要。抑制素βA属于转化生长因子-β 超家族,近年因在多种肿瘤中上调并参与肿瘤进展而成为研究焦点。但它在结直肠癌中,尤其是肿瘤免疫和细胞死亡模式方面的精确机制仍不清楚。周艳宏课题组研究发现,抑制素 βA作为支架蛋白稳定线粒体蛋白SLC25A10,一方面通过琥珀酸-琥珀酸受体轴诱导肿瘤相关巨噬细胞M2极化,重塑免疫微环境;另一方面激活mtGSH/GPX4轴抑制线粒体依赖性铁死亡,最终促进结直肠癌恶性进展。这一发现不仅揭示了INHBA在结直肠癌进展中的多重机制,还为开发新治疗策略提供了候选靶点。
论文链接:https://doi.org/10.1038/s41392-025-02518-y
张剑英团队在国际衰老顶刊《Nature Aging》发表专家意见
近日,中南大学湘雅口腔医OD(中国)官方(湘雅口腔医院)牙体牙髓科副研究员张剑英博士所在团队在国际权威期刊《自然衰老》(Nature Aging)(中科院一区TOP,IF=19.5)发表专家意见(DOI:10.1038/s43587-025-00947-6,文章链接:https://www.nature.com/articles/s43587-025-00947-6),聚焦烟酰胺腺嘌呤二核苷酸(NAD+)在延缓自然衰老及衰老相关疾病临床应用上的研究现况、前景与挑战,为从事NAD+领域研究的专业人士提供了最新的临床进展与科学路线图,对NAD+未来的研究与临床转化建立了里程碑式的指导意义。





